牛顿把他的第一原则,立足在了有神学色彩的目的化设计及其论断“大自然喜欢简单性”上。这种简单性,在生物学中,也体现在基因表达调控的模块化分子设计上。在表达调控的各阶段中,调控蛋白经常包括一个识别靶分子的结合模块,和一个激活/抑制生化过程的功能模块。我们将这一简单性的设计原则运用到了蛋白质工程上,人工合成蛋白因子来操控RNA代谢过程,如剪接和降解。
我们利用一个独特的RNA结合结构域:PUF结构域。PUF包含8个重复单元去识别8碱基的RNA靶序列(图1A)。每个PUF重复单元中,都有三个氨基酸决定着特异性结合到哪一种碱基上。我们已经研究清楚,四种碱基分别是如何被识别的。因此,PUF结构域的特异性可以通过改变每个重复单元来重编程,我们也能够设计出具备定制化特异性的各种PUF结构域。
人工剪接因子(Engineered splicing factors,ESFs)
大量的天然剪接因子,都有模块化构象:分离的RNA结合结构域和剪接激活/抑制功能结构域。我们将PUF结构域与剪接调控功能域(SRSF1的Arg/Ser-rich结构域,或hnRNP A1的Gly-rich结构域)组装为人工剪接因子(图1B)。得到的ESFs能够作为剪接激活因子(PUF-RS)或抑制因子(PUF-Gly)起作用,特异性地调控不同类型的可变剪接。
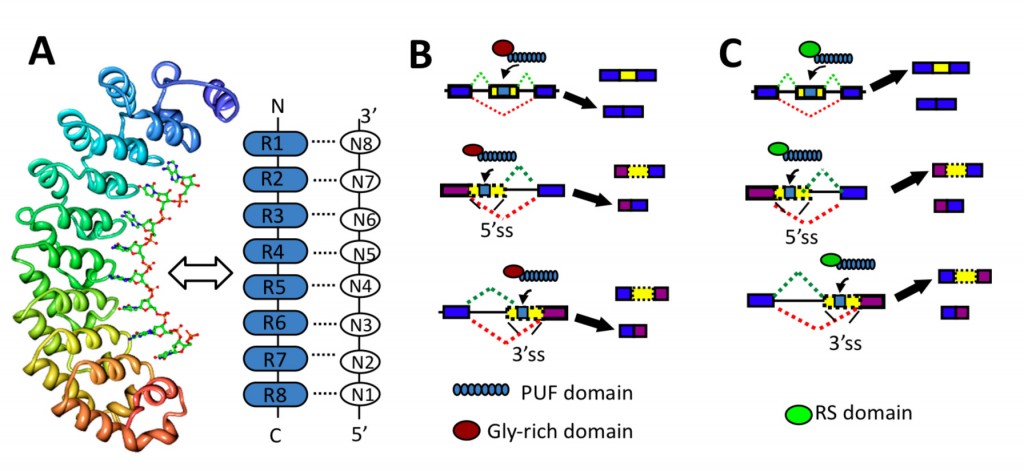 图1.利用模块化合成系统设计构建特异性调控RNA剪接加工的人工蛋白。(A)PUF-RNA的结合模型;(B)将PUF结构域与Gly-rich功能域组装为人工剪接抑制因子;(C)将PUF结构域与RS-rich功能域组装为人工剪接激活因子。
图1.利用模块化合成系统设计构建特异性调控RNA剪接加工的人工蛋白。(A)PUF-RNA的结合模型;(B)将PUF结构域与Gly-rich功能域组装为人工剪接抑制因子;(C)将PUF结构域与RS-rich功能域组装为人工剪接激活因子。
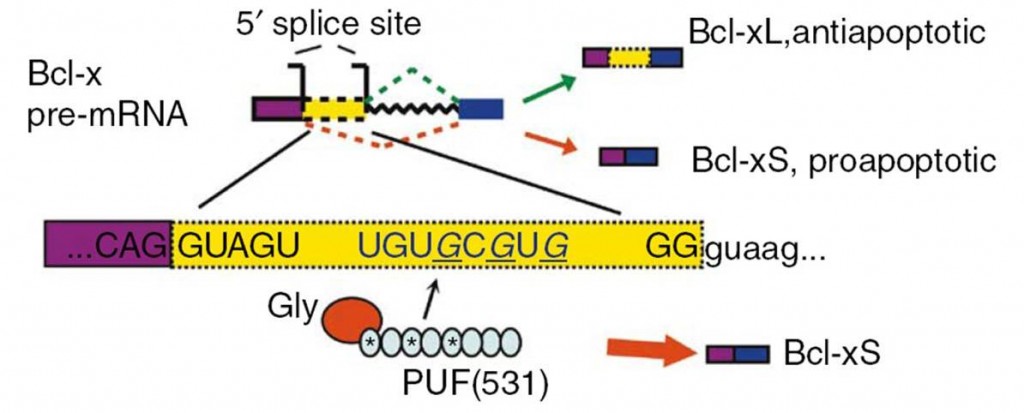
我们设计了一个PUF-Gly人工剪接因子,来特异性地靶向Bcl-x的pre-mRNA,使剪接生成更多抑癌的长isoform(Bcl-xL),而减少利于癌症发生的短isoform(Bcl-xS)。这一剪接isoforms的分布变化,在多个癌细胞系中使癌细胞对多种化疗药物变得敏感化。
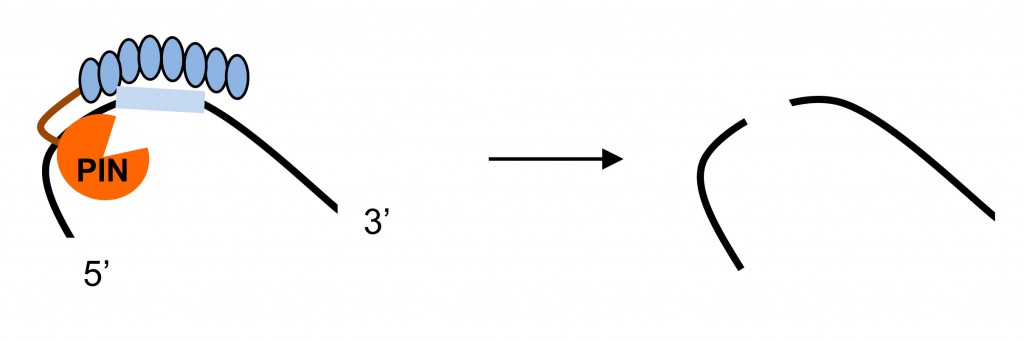
RNA的特异性切割对于RNA的体外操控和体内沉默都十分关键。但是,虽然进行了大量探索,在自然界中仍然没有发现一种简单的酶能够序列特异性地切割RNA。大多数RNA内切酶或者序列特异性十分有限,或者依靠特殊的结构识别靶RNA,或者需要通过guide RNA来匹配靶RNA。我们利用模块化合成系统,对PUF和RNA内切酶进行组装,从而构建了可对任意RNA进行特异性定点切除的人工RNA内切酶(artificial site-specific RNA endonuclease, ASRE)。将ASRE用来切除线粒体编码的RNA,使得对线粒体基因组的编辑调控成为可能。我们进一步构建人工RNA内切酶来特异性降解强直性肌营养不良症中的毒性RNA,从而研发了针对此遗传症的一种新疗法。