RNA剪接由剪接小体识别5'端和3'端剪接位点来催化完成。然而剪接位点通常只对转录组RNA的剪接提供一半信息,其余信息则是由前体RNA中的顺式剪接调控元件(splicing regulatory cis-elements,简称SRE)提供,这些元件可作为剪接增强子或沉默子来调控剪接位点。根据SRE功能及其在前体RNA中的位置可被分为外显子剪接增强子(ESE, exonic splicing enhancer)或沉默子(ESS, exonic splicing silencer)以及内含子剪接增强子(ISE, intronic splicing enhancer)或抑制元件(ISS, intronic splicing silencer)。这些SRE通过募集反式剪接因子来激活或抑制相邻的剪接位点。因此在全转录组层面上鉴定所有SRE及相应剪接因子有助于系统性阐析RNA可变剪接的调控规则(又称“剪接密码”)。
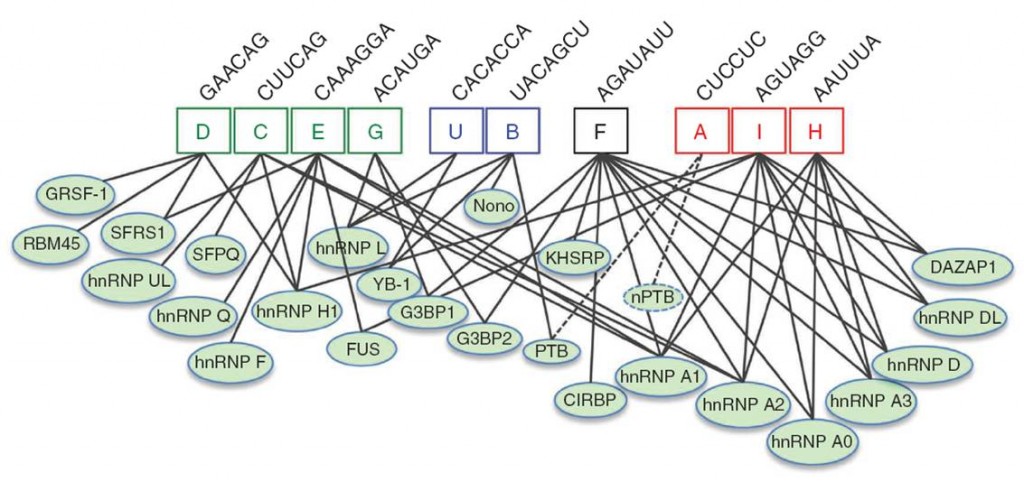
我们运用分子生物实验方法和计算生物学预测来阐释RNA的选择性剪接规则,并集中研究癌症细胞中剪接的调控。通过前期的工作,我们已经系统性地鉴定出各类顺式调控元件(SREs)以及与其结合的剪接因子(下图),并阐明了个别剪接因子在癌症发生中的作用。下一步我们将系统性研究这些顺式调控元件与剪接因子的相互作用关系,并在基因组的层面上找到调控规律。我们将对这些调控网络建立计算生物学模型,并用这些模型(或剪接密码)来预测基因突变或基因多样性对RNA剪接的影响。
我们也对发现反式剪接因子感兴趣。剪接因子和SREs之间并不是一对一的作用关系,而是形成一个深度交联的互作网络,可能在特异性结合之外提供了某些可塑性。大多数剪接因子都包含一或多个RNA识别结构域,以及一个重复序列motif,并经常以模块化方式起作用(即包含一个识别靶pre-mRNA的RNA结合模块,和一个激活/抑制剪接的功能模块)。我们正在研究这种相互作用网络如何影响细胞内的剪接现象。由于剪接因子可能作为药物靶点,这一研究具有重大的临床应用价值。一旦我们找到了和疾病相关的剪接异常,我们就可能预测哪些剪接因子导致了这些异常,从而设计靶向这些剪接因子的新治疗方法。
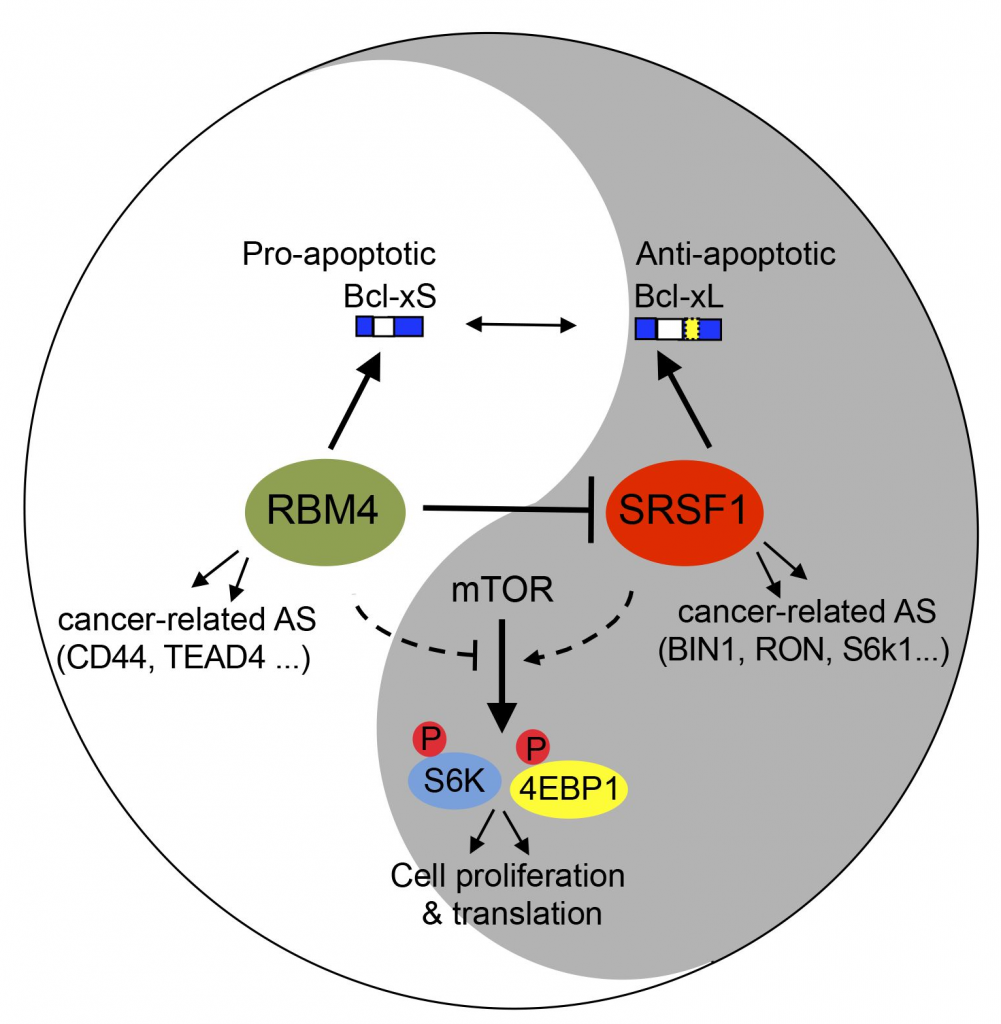
RNA可变剪接的异化是肿瘤发生的重要分子标志,并影响一系列肿瘤发展的重要过程,包括细胞凋亡,肿瘤血管生成,肿瘤的侵袭与转移等。因此研究在癌细胞中RNA可变剪接异化的专一性调控及其生物学功能对于理解癌症发生有重要意义。
我们将集中研究癌细胞和正常细胞的剪接密码的差异。目前已有大量证据表明RNA选择性剪接异常会引起肿瘤发生和发展过程中一些重要标志性的变化,其中包括细胞凋亡,肿瘤血管生成,上皮细胞间质化改变,肿瘤的侵袭与转移等过程的变化。在前期的工作中,我们发现许多剪接因子在癌细胞中的表达水平有显著变化(下图),并对其中一些因子的体内调控靶点(下游基因)通过转录组测序进行了鉴定,还进一步研究这些剪接因子影响癌症发生的分子机理。今后我们将继续在基因组水平系统性鉴定所有已知剪接因子的体内靶向基因,并且研究在癌症中剪接因子的改变对细胞周期的影响。我们还将利用癌症患者的转录组测序结果来找出不同癌症的基因剪接特点。